 Pharmaceutical Data Integrity
Pharmaceutical Data Integrity
(Intégrité des données pharma)
By Jean-Pierre Amiel, ASQ Senior, CQA ret., Secretary, Web committee Chair and Audit Chair. (Texte en français)
In this presentation on September 28th, 2022, Kia Kahhali, B. Eng. and founder of APS Compliance Consultants Inc (also known as “Access Pharma Solutions”), a private firm of experts assisting the Pharmaceutical and Food industries gave us insight and a plethora of information on how quality, compliance, validation, and regulatory are affecting the quality and integrity of the data in pharmaceutical, biopharmaceutical and allied industries.
Well once again, a look into the ever evolving world of data documentation of processes, but for me, a real update on the thoughts that go into the preparation and the life cycle of DATA. Let’s be truthful, it was actually “overwhelming” as our presenter tried to squeeze so much information into his 90 minutes presentation that it was like… Data overload 😁, pun intended.
Kia started off ensuring that the 33 participants present understood that there were two basic definitions of what data was, and that the Data Integrity Scope is much wider than just the analytical testing results, as it includes sampling, inspection and testing activities and any deviation and investigation through the process.
One of the most interesting aspects of his presentation was his comment that he was using standards written over 20 years ago and which have had few recent updates — not because there is nothing new in data principles — but rather because the principles remain “d’actualité“, they are still current. He also stated that data integrity controls should be based on the risks of losing that data. But the most challenging, and I have faced that one, is that the system used MUST allow the future reader/regulator/auditor to access and read the ORIGINAL data. Now there is a problem . . . as he suggested that only the original data stream be stored, not the interpreted or summarized versions, so that it may be reproduced. Is this a requirement for particular domains? This also infers that the ‘raw’ data must survive whatever technological evolution happens. And of course, this means that the methods used for validation and data transfer are also part of laboratory records and have to be included within the scope of the data integrity system.
- Raw data definition: The original (data) which can be described as the first-capture of information including all contextual metadata from sampling to reporting, whether recorded on paper or electronically, permitting full reconstruction of the activities and evaluating reports. Information that originally captured in a dynamic state should remain available in that state.
- Interpretation: Whether this has been captured in a dynamic state and generated electronically, paper copies cannot be considered as ‘raw data’.
As for the system requirements, there was the usual management support and involvement but also the need for employee training and the recording of that commitment, as the objective is to “ensure an engagement of the whole organization from the board room down to the laboratory bench and production floor“. As an aside to this item, ASQ has been requiring for the last four years that all your Section Leadership Team follow and pass an online course on the General Data Protection Regulation (GDPR), a European privacy and security system, which imposes obligations on organizations to protect various members’ personal information – a commitment.
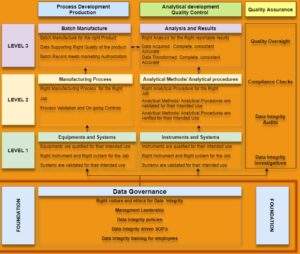
Kia explained that for the data integrity approach, regulatory agencies have opted to issue Guidance documents rather than modifying the regulations so as to offer clarifications. He presented a Data Integrity Model for a pharmaceutical quality system that has three levels and explained that a Computerized Maintenance Management System, such as his company’s Alleye software, can best address the Level 1 – Equipment and systems and is working on another system for Level 2 – Analytical Methods and procedures. In his PDF handout, Kia provided a reference library of the various documents quoted.
Do you remember paper and pen? That was relatively easy to store, but it falls into the category of interpreting information. What about magnetic tape cassettes and reels, 8 inch, 5 1/4 inch and 3 1/2 inch diskettes, the computers and software to operate and drive these? I would have liked to have asked these clarifications, but there was so much more about the strategies and structures of the data integrity systems that we just barely made it in the allocated time. This may mean that another session on this subject is to be considered.
You definitely missed a good overview of this popular subject – an 87% vote by the participants. Well done! Interesting again! Wonderful evening.
Thank you all for participating!
Ce 28 septembre 2022, Kia Kahhali, B. ing. et fondateur de APS Compliance Consultants Inc (également connu sous le nom de “Access Pharma Solutions”), une société privée d’experts qui assiste les industries pharmaceutiques et alimentaires, nous a donné un aperçu et une pléthore d’informations sur la qualité, la conformité, la validation et les réglementations qui affectent la qualité et l’intégrité des données dans les industries pharmaceutiques, biopharmaceutiques et apparentées.
Une fois de plus, nous avons jeté un coup d’œil dans le monde en pleine expansion de la documentation des processus de données, mais pour moi, il s’agissait d’une véritable mise à jour des réflexions sur la préparation et le cycle de vie du DATA (données). Soyons honnêtes, c’était vraiment “accablant” car notre présentateur a essayé de condenser tellement d’informations dans sa présentation de 90 minutes que c’était comme . . . une surcharge de données 😁, jeu de mots intentionnel.
Kia a commencé par s’assurer que les 33 participants présents comprenaient qu’il y avait deux définitions de base de ce que sont les données et que le champ d’application de l’intégrité des données est beaucoup plus large que les seuls résultats des tests analytiques, car il comprend l’échantillonnage, l’inspection et les activités de test, ainsi que tout écart et toute enquête au cours du processus.
L’un des aspects les plus intéressants de sa présentation a été son commentaire sur le fait qu’il utilise des normes écrites il y a plus de 20 ans et qui ont eu peu de mises à jour récentes – non pas parce qu’il n’y a rien de nouveau dans les principes relatifs aux données – mais plutôt parce que les principes restent “d’actualité“. Il a également déclaré que les contrôles de l’intégrité des données devraient être basés sur les risques de la perte de ces données. Mais le plus difficile, et j’y ai été confronté, est que le système utilisé DOIT permettre au futur lecteur/régulateur/auditeur d’accéder et de lire les données ORIGINALES. Il y a maintenant un problème . . . car il a suggéré que seul le flux de données original soit stocké, et non les versions interprétées ou résumées, afin qu’il puisse être reproduit. S’agit-il d’une exigence pour des domaines particuliers? Cela implique également que les données “brutes” doivent survivre à toute évolution technologique. Et bien sûr, cela signifie que les méthodes utilisées pour la validation et le transfert des données font également partie des archives du laboratoire et doivent être incluses dans le champ d’application du système d’intégrité des données.
- Définition des données brutes: L’original (données) qui peut être décrit comme la première capture de l’information, y compris toutes les métadonnées contextuelles, de l’échantillonnage au rapport, qu’il soit enregistré sur papier ou électroniquement, permettant la reconstruction complète des activités et l’évaluation des rapports. Les informations initialement capturées dans un état dynamique doivent rester disponibles dans cet état.
- Interprétation: Qu’elles aient été capturées dans un état dynamique et générées électroniquement, les copies papier ne peuvent être considérées comme des “données brutes”.
En ce qui concerne les exigences du système, il y avait le soutien et l’implication habituels de la direction, mais aussi le besoin de formation des employés et l’enregistrement de cet engagement, car l’objectif est de “garantir un engagement de l’ensemble de l’organisation, de la salle du conseil jusqu’au banc de laboratoire et à l’atelier de production“. J’ouvre une parenthèse ici, l’ASQ exige depuis quatre ans que toute l’équipe de direction de votre section suive et réussisse un cours en ligne sur le Règlement général sur la protection des données (RGPD), un système européen de protection de la vie privée et de sécurité, qui impose aux organisations des obligations de protection des informations personnelles des différents membres – un engagement.
Kia a expliqué que pour l’approche d’intégrité des données, afin d’offrir des clarifications, les organismes de réglementation ont choisi de publier guides d’orientation plutôt que de modifier les normes. Il a présenté un modèle d’intégrité des données pour un système de qualité pharmaceutique à trois niveaux et a expliqué qu’un système de gestion de la maintenance informatisée, tel que le logiciel Alleye de sa société, peut mieux traiter le Niveau 1 – Équipements et systèmes et qu’il travaille sur un autre système pour le Niveau 2 – Méthodes et procédures analytiques. Kia a aussi fourni une bibliothèque de référence des différents documents cités dans sa présentation PDF.
Vous souvenez-vous du papier et du stylo? C’était relativement facile à conserver, mais cela entre dans la catégorie de l’interprétation de l’information. Qu’en est-il des cassettes et des bobines de bandes magnétiques, des disquettes de 8 pouces, 5-1/4 pouces et 3-1/2 pouces, des ordinateurs et des logiciels pour les faire fonctionner et les piloter? J’aurais aimé demander ces précisions, mais il y avait tellement de choses à dire sur les stratégies et les structures des systèmes d’intégrité des données que nous avons tout juste réussi à finir dans le temps imparti. Cela signifie peut-être qu’une autre session sur ce sujet est à envisager.
Vous avez définitivement manqué un bon survol d’un sujet populaire – un vote de 87% par les participants. Bien fait! Intéressant encore une fois! Super soirée.
Merci à tous pour votre participation!
Our next LIVE EVENT | Notre prochain ÉVÉNEMENT EN DIRECT:
2022.10.26, 18h30
• General Assembly | Assemblée Générale
• Workshop | Atelier: How to manage multiple Management System certifications | Comment gérer plusieurs certifications de systèmes de gestion
Your host | Votre hôte: Ray Dyer (Bilingual Event | Événement Bilingue). Réservations| Informations
